Физическая география часть 35
Пространственные изомеры (стереоизомеры) можно разделить на два типа: цис-транс-изомеры и оптические изомеры.
Цис-транс-изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах заместители у различных атомов углерода могут оказаться по одну сторону (цис•) или по разные стороны (транс ) от некоторой выбранной плоскости:
,Н
Н3СЧ /1
/ \
|
Н |
|
транс бутен 2 Сч /СНз X н’ чн |
СН3
Н:
2. По типу реакции:
а) присоединение
RCH=CH2 + XY – Ч RCHX—CH2Y
б) замещение
RCH2X + Y – Ч RCH2Y + X
в) отщепление (элиминирование)
RCHX—CH2Y -+ RCH=CH2 + XY
г) полимеризация
п(СН2=СН2) -Ч (—СН2—СН2—)„
3. Окислительно-восстановительные реакции.
Окисление и восстановление в органической химии связывают с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы Н и (или) приобретает атомы О. Окислитель в общем виде обозначают символом [О].
Вещество восстанавливается, если оно приобретает атомы Н и (или) теряет атомы О. Восстановитель в общем виде обозначают символом [Н].
цис-бутен-2
Цис-транс-изомеры отличаются своими физическими и химическими свойствами.
Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным изображением. Таким свойством обладают молекулы, имеющие асимметрический центр — атом углерода, связанный с четырьмя различными заместителями.
Оптические изомеры имеют почти одинаковые физические и химические свойства.
Взаимное влияние атомов в молекуле
Взаимное влияние атомов в молекуле передается через систему ковалентных связей с помощью электронных эффектов. Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
Индуктивный эффект (I) — смещение электронной плотности по цепи о^связей.
Мезомерный эффект (М) — смещение электронной плотности по цепи ff-связей.
-It —CI, —Вг, —ОН, —NH2; +/: —сн3, —С2Н5;
-М: —СН=Ю, —СООН, —N02; +М: —ОН, —NH2.
Классификация органических реакций
1. По типу разрыва связей, а) Радикальные реакции идут с гомолитическим разрывом ковалентной связи:
а:в -+ а – + – в
б) Ионные реакции идут с гетеролитическим разрывом ковалентных связей:
а:в – ч а:» + в+
16. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ)
Алканы — это предельные алифатические углеводороды. Общая формула гомологического ряда алканов СпН2п+2.
Простейшие представители: СН4 — метан, С2Нв — этан, С3Н8 — пропан, С4Ню — бутан (2 изомера).
Углеводородные радикалы (общее обозначение —R): —СН3 — метил, —C2Hs — этил, —С3Н7 — пропил (2 изомера), —С4Н9 — бутил (4 изомера).
Изомерия. 1. Изомерия углеродного скелета (начиная с С4Н10). 2. Оптическая изомерия {начиная с С7Н16).
Строение, ар – гибридизация атомов углерода, сг-связи С—С и С—Н, углы между связями 109,5°.
Физические свойства. При обычных условиях Ci—С4 — газы, С5—С17 — жидкости, начиная с Ci8 — твердые вещества. Алканы практически нерастворимы в воде, но хорошо растворимы в неполярных растворителях (бензол и др.).
Получение. 1. Гидрирование непредельных углеводородов в присутствии металлических катализаторов (Ni, Pd) при нагревании:
СН3—СН=СН2 + Н2 – Ч СНз—СН2—СН3.
2. Реакция Вюрца.
C2H5Br + 2Na + ВгС2Н5 – ч
—+ С2Н5—С2Н5 + 2NaBr.
Пригодна только для получения симметричных алканов.
3. Гидролиз карбида алюминия (лабораторный метод получения метана):
А14С3 + 12Н20 – ч 3CH4t + 4А1(ОН)3.
|
613 |
|
химия |
Химические свойства. В обычных условиях алканы химически инертны, что объясняется высокой прочностью о^связей С—С и С—Н. Неполярные связи С—С и С—Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакциях в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
|
С1о |
|
С1о |
1. Галогенирование. При взаимодействии ал – канов с хлором и бромом под действием УФ – излучения или высокой температуры образуется смесь продуктов от моно – до полигалогензамещен- ных алканов:
CU
|
+ СН3С1 |
|
СН4 |
♦ СН2С12
|
-НС1 |
|
—НС1 |
—НС1
С1о
|
СНС13 |
ч СС14.
—НС1
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140 °С и небольшом давлении протекает радикальная реакция:
СН3—СН3 + HN03 – ч СНз—СН г—N02 + Н20.
3. Крекинг — радикальный разрыв связей С—С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С8Н18 -Ч С4Н10 + С4Н8, 2СН4 – Ч С2Н2 + ЗН2.
4. Окисление. При мягком окислении метана кислородом воздуха могут быть получены СН3ОН, Н2СО, НСООН. На воздухе алканы сгорают до СОг и Н20:
nC02 + (п + 1)Н20.
17. АЛКЕНЫ. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ Алкены (этиленовые углеводороды)
Алкенами называются непредельные углеводороды, молекулы которых содержат одну двойную связь. Общая формула гомологического ряда алке – нов С„Н2„.
Простейшие представители: СН2=СН2 — этилен, СНз—СН=^Н2 — пропен (пропилен).
Углеводородные радикалы: —СН==СН2 — винил, —СН2—СН==СН2 — аллил.
Номенклатура. Самая длинная цепь должна содержать двойную связь. Нумерация цепи начинается с того края, ближе к которому двойная связь. В названия соответствующего алкана окончание ан заменяется на ен.
Изомерия. 1. Изомерия углеродного скелета (начиная с С4Нв). 2. Изомерия положения двойной связи (начиная с C4Hs). 3. Цис-транс-изомерия (начиная с бутена-2). 4. Межклассовая изомерия с цИ – клоалканами (СпНгп).
Строение. яр2-гибридизация атомов углерода, 3 сг-связи располагаются в одной плоскости под углом 120° друг к другу, 7г-связь образована р-элек – тронами соседних атомов углерода. Двойная связь является сочетанием сг – и 7г-связей.
Физические свойства. При обычных условиях С2—С4 — газы, С5—С17 — жидкости, начиная 0 Сю — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение. 1. Крекинг алканов:
С7Н16 – ч С4Н10 + СНз—СН=СН2.
2. Реакции элиминирования.
а) Дегидрогалогенирование происходит при действии спиртовых растворов щелочей на моногало – гениды:
СН3—СН2—СНВг—СНз + КОН(сп) -> – ч СНз—СН=СН—СНз + КВг + Н20.
Правило Зайцева: отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее ги■ дрогенизированного атома углерода (т. е. связанного с наименьшим числом атомов водорода).
б) Дегидратация спиртов происходит при их нагревании с серной кислотой (t > 150 °С) или пропускании паров спирта над катализатором.
СНз—СН(ОН)—СНз – Ч – Ч СН3—СН==СН2 + Н20.
в) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
СН2Вг—СНВг—СН2—СНз + Mg – ч
-Ч СН2=СН—СН2—СН3 + MgBr2.
г) Дегидрирование алканов проводят при 500 °С в присутствии катализатора:
СН3—СН2—СН3 СН3—СН=СН2 + Н2.
Химические свойства. Многие реакции алке- нов протекают по механизму электрофилъного при соединения.
1. Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (НС1, HBr) образуются алкилгалогениды.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алке – нам водород присоединяется к более гидрогенизи – рованному атому углерода при двойной связи:
СН3—СН=СН2 + HBr -+ СН3—СНВг—СН3.
Правило Марковникова объясняется электронными эффектами.
2. Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Присоединение воды идет по правилу Марковникова:
СН3 СН3
i н3ро4 i
сн3—с=сн2 + н2о *> сн3—сн3.
ОН
3. Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вг2 —► ВгСН2—СН2Вг.
|
f |
При нагревании до 500 °С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
|
на |
СНз—СН==СН2 + С12 —+ – f С1—СН2—СН=СН2 + НС1.
4. Окисление. а) Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (диолов):
ЗСН2=СН2 + 2КМп04 + 4Н20 -+ ЗСН2—СН2 + 2Mn02 + 2КОН.
ОН ОН
б) При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или С02:
СН3—СН=€Н—СН3 2СН3—СООН.
в) Окисление этилена кислородом при 200 °С в присутствии CuCl2 и PdCl2 приводит к ацетальде – гиду:
СН2=СН2 + 1/202 -+ СН3—СН==0.
5. Гидрирование алкенов приводит к алканам:
I, Ni
СН3—СН=СН2 + Н2 ———► СН3—СН2—СНз.
6. Реакция полимеризации.
пСН2=СН2 —+ (—СН2—СН2—)ц.
Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм).
7. Качественные реакции на алкены — обесцвечивание бромной воды и раствора перманганата калия.
Диеиовые углеводороды (алкадиены)
Алкадиенами называются непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СПН2„_2.
Если двойные связи разделены в цепи только одной аг-связыо, то их называют сопряженными, поскольку 7г-электроны двойных связей в этом случае образуют единое 7г-электронное облако. Простейшим сопряженным диеном является бутадиен-1,3:
СН2=СН—СН=СН2.
Изомерия. 1. Изомерия углеродного скелета (начиная с C5Hg). 2. Изомерия положения двойных связей (начиная с CsHs). 3. Цис-транс-изомерия (начиная с пентадиена-1,3). 4. Межклассовая изомерия с алкинами (С„Н2п_2).
Получение. 1. Дегидрирование алканов:
Нз
СН3—СН—СН2—СН3
f
—► СН2=С—СН=СН2 + 2Н2.
2. Реакция Лебедева — одновременное дегидрирование и дегидратация этанола с катализаторами на основе ZnO и А1203:
2С2Н5ОН б50°С) —» СН2=СН—СН=СН2 + Н2 + 2Н20.
Химические свойства. 1. Реакции электро- фильного присоединения.
СН2Вг—СНВг—СН=СН2
Br2 J 1 ^ присоединение
СН2==СН—СН==СН2
Вг2 1,4-присоединение
СН2Вг—СН=€Н—СН2Вг
2. Полимеризация алкадиенов может протекать как 1,2- или 1,4-присоединение:
пСН2=СН—СН=СН2 ^ 1
(—СН2—СН=€Н—СН2—)„.
18. АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ)
Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СпН2„-2.
Простейшие представители: СН==СН — ацетилен, СНз—С==СН — пропин (метилацетилен).
Номенклатура. Самая длинная цепь должна содержать тройную связь. Нумерация цепи начинается с того края, ближе к которому тройная связь. В названии соответствующего алкана окончание •ан заменяется на ин.
Изомерия. 1. Изомерия углеродного скелета (начиная с CgHg). 2. Изомерия положения тройной связи (начиная с C^Hg). 3. Межклассовая изомерия с алкадиенами (СПН2„_2).
Строение, sp-гибридизация атомов углерода, две гт-связи располагаются на одной линии под углом 180° друг к другу, две 7г-связи образованы р-электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях. Тройная связь является сочетанием одной а – и двух 7г-связей.
Физические свойства. При обычных условиях Сг—С4 — газы, С5—Cie — жидкости, начиная с Ci8 — твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов.
Получение. 1. Общий способ — дегидрогалоге – нирование:
СН3—СВг2—СН3 + 2КОН этанол> —> СНз—С==СН + 2КВг + 2Н20.
2. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
2СН4 1600 °С) СН=€Н + ЗН2.
В лаборатории ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н20=Са(0Н)2 + C2H2t-
Химические свойства. 1. Реакции присоединения. а) Галогенирование. Галогены присоединяются к алкинам в две стадии:
Вг, Вго
СНнаСН —U СНВг=СНВг —4
—� СНВг2—СНВг2.
Алкины обесцвечивают бромную воду.
б) Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Присоединение второй молекулы галоге – новодорода протекает по правилу Марковникова:
снг=ен сн2=снс1 сн3—chci2.
в) Гидратация (реакция Кучерова). Присоединение воды к алкинам катализируется солями ртути (II):
и 2+ н+
сн==сн + н20 g • > —> [СН2=СН—ОН] -+ сн3—сн==о.
2. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, являются их слабые кислотные свойства. Алкины способны образовывать соли, называемые ацетиленидами’.
2R—С==С—H + 2Na -+ 2R—С=эС—Na + Н2.
Ацетиленид серебра легко образуется и выпадает в осадок при пропускании ацетилена через аммиачный раствор оксида серебра:
СН==СН + Ag20 -+ Ag—С=эС—AgJ. + H20.
3. Тримеризация. При пропускании ацетилена над активированным углем при 600 °С образуется бензол:
ЗНС==СН -+ СвНв.
4. Реакции окисления и восстановления, а) Алкины легко окисляются перманганатом калия. В результате реакции образуются карбоновые кислоты:
R—СгэС—R’ + [О] + Н20 – f -+ R—СООН + R’—СООН.
б) В присутствии металлических катализаторов алкины присоединяют молекулы водорода:
СН3—С=€Н СН3—СН=СН2 СН3—СН2—СН3.
5. Качественные реакции на тройную связь. а) Обесцвечивание бромной воды и перманганата калия, б) Реакция с аммиачным раствором оксида серебра в случае концевого положения тройной связи.
19. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец. Общая формула гомологического ряда бензола СлН2п-ц.
Простейшие представители: СдНд — бензол, СдНб—СНз — толуол.
Углеводородные радикалы: CgHs— — фенил, CgHg—СН2 бензил.
Изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в
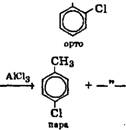
ядре. Дизамещенные производные бензола существуют в виде трех изомеров, различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто (о-), мета (м ), пара (п-).
|
СНз
JM-КСИЛОЛ |
СНз
СНз
|
СНз |
СНз
СНз
б) Нитрование. Бензол легко реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
сен0 + hno3 H*soS сен5—no2 + н2о.
в) Алкилирование по Фриделю — Крафтсу — см. выше.
г) Алкилирование алкенами.
А! С!3
СеНе + СН2==СН—СНз
1,2′Диметилбенэол 1,3-диметилбензол 1,4-диметилбензол
|
f. Ni |
|
+ зн2 |
Строение. Все шесть атомов углерода в молекуле бензола находятся в вр2-гибридном состоянии. Каждый атом углерода образует 3 ст-свяаи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (<т – скелет молекулы бензола).
Каждый атом углерода имеет одну негибриди – зованкую р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое ir – электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленно – го цикла.
|
hv. |
|
+ ЗС12 |
Физические свойства. Первые члены гомологического ряда бензола — бесцветные жидкости со специфическим запахом. Они легче воды и в ней нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Получение. 1. Дегидроциклизация алканов (катализаторы — Pt, Сг2Оз):
СНз—(СН2)5—СНз С6Н5—СНз + 4Н2.
|
СНз |
2. Дегидрирование циклоалканов. СНз СН3
f. Pt
|
+ зн2. |
|
hv. |
|
+ С12 |
6
С6Н5-СН(СНз)2.
2. Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях.
а) Гидрирование’.
О
б) Присоединение хлора протекает под действием жесткого ультрафиолетового излучения с образованием твердого продукта — гексахлорциклогек – сана (гексахлорана) CgHgClg:
С1
CK-y^ci ci
Химические свойства гомологов бензола связаны со взаимным влиянием алкильного радикала и бензольного кольца.
1. Реакции в боковой цепи. Атомы водорода в боковой цепи могут замещаться на галоген при нагревании или УФ-облучении:
СН2С1
+ НС1.
метилциклогексан толуол
Тримеризация ацетилена:
Сект, 600°С
|
+ С6Нб. |
ЗНС=СН
Замещение в бензольном кольце происходит в присутствии катализатора А1С13 в орто – и пара – положения:
4. Алкилирование бензола (реакция Фриделя— Крафтса):
+ к—ci д> ГГ Y R + нс1.
Химические свойства бензола. 1. Реакции элек – трофильного замещения.
а) Галогенирование. Бензол взаимодействует с хлором или бромом в присутствии катализаторов — безводных А1С13, FeCle, А1Вгз:
,С1
AlClo
|
+ С12 |
+ НС1.
СНз
|
СНз AlClo + С12 U
+ НС1 |
2. Окисление. При действии на гомологи бензола перманганата калия и других сильных окислите-
лей боковые цепи окисляются, причем от всей цепи остается только один атом углерода:
|
|
СН2—СНз СООН
[0]- » – + со2.
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
СНз СООН
ф + 2С02.
СООН
СНз СНз
|
I |
Правила ориентации (замещения) в бензольном кольце. Заместители (ориентанты) 1-го рода направляют последующее замещение преимуще – ственно в орта – и пара-положения. К ним относятся следующие группы: —CrtH2n+i, —ОН, —NH2, —С1 (—F, —Br, —I).
|
+ ЗНВг. |
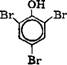
Все заместители 1-го рода (кроме галогенов) увеличивают активность бензольного кольца и облегчают вступление второго заместителя. Так, фенол легко реагирует с бромной водой:
ОН
+ ЗВг2
Заместители (ориентанты) 2-го рода направляют последующее замещение преимущественно в мета-положение. К ним относятся следующие группы: —N02, —СООН, —СН==0.
|
+ н2о. |
СООН СООН
+ hno3
Все заместители 2-го рода уменьшают активность бензольного кольца и затрудняют вступление второго заместителя.
20. СПИРТЫ И ФЕНОЛЫ
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп —ОН, связанных с углеводородным радикалом. Спирты, у которых гидроксильная группа связана с бензольным кольцом, называются фенолами.
В зависимости от числа гидроксильных групп спирты делят на одно-, двух – и трехатомные. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RCH2—ОН), вторичные (R2CH—ОН) и третичные (R3C—ОН).
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+ [ОН. Простейшие представители. Первичные: СН3ОН — метанол (метиловый спирт), СНзСН2ОН — этанол (этиловый спирт), СН3СН2СН2ОН — пропанол-1 (пропиловый спирт). Вторичные:
СН з—СН—СН з ОН
пропанол 2 (изопропиловый спирт) Третичные:
СНз
2 метилпропанол 2
СНз ^ СНз (mpem-бутиловый спирт)
ОН
Изомерия. 1. Изомерия углеродного скелета (начиная с С4Н9ОН). 2. Изомерия положения гидрок — сильной группы (начиная с С3Н70Н). 3. Межклассовая изомерия с простыми эфирами.
Физические свойства. Низшие спирты (до С15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Спирты имеют высокие температуры плавления н кипения за счет образования водородных связей.
Получение. 1. Гидратация алкенов.
Н3РО4
СНз—СН=СН2 + Н20 ——U СН3—СН—СН3.
ОН
Реакция протекает по правилу Марковникова.
2. Гидролиз алкилгалогенидов под действием водных растворов щелочей.
R—Br + NaOH — f R—ОН + NaBr.
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, при восстановлении кетонов — вторичные:
СН3—СН=0 + 2[Н] – V СН3СН2ОН,
СН3—СО—СН3 + 2[Н] – V СН3—СН(ОН)—СН3.
Химические свойства. 1. Реакции с разрывом связи О—Н. а) Кислотные свойства спиртов выражены очень слабо. Спирты реагируют с щелочными металлами
но не реагируют с щелочами. В присутствии воды алкоголяты полностью гидролизуются: