Физическая география часть 36

С2Н5ОК + Н20 – f С2Н5ОН + КОН. Это означает, что спирты — более слабые кислоты, чем вода,
б) Образование сложных эфиров под действием минеральных и органических кислот:
Н+
СН8—СО—ОН + Н—ОСНз pt
<pt СН3СООСН3 + н2о.
в) Окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в кар – боновые кислоты.
R_CH2—ОН R—СН=0 -!-!> R—СООН. Вторичные спирты окисляются в кетоны:
R—СН—R’ 1 R—С—R’ •
|>Н I
Третичные спирты более устойчивы к окислению.
2. Реакции с разрывом связи С—О.
а) Внутримолекулярная дегидратация с образованием алкенов происходит при сильном нагревании спиртов с водоотнимающими веществами:
H2SQ4.f>150°C
СН8—СН2—СН2—ОН
-4 СНз—CH=dCH2 + н2о.
б) Межмолекулярная дегидратация с образованием простых эфиров происходит при слабом нагревании спиртов с водоотнимающими веществами:
HoSCb, «150°С
2С2Н5ОН i 4——- ► С2Н5—О—С2Н5 + н2о.
в) Слабые оснбвные свойства спиртов проявляются в обратимых реакциях с галогеноводородами:
С2Н5ОН + HBr <=s С2Н5Вг + Н20.
Многоатомные спирты
|
<рн2—<рн—^Н2 ОН ОН ОН глицерин (пропантриол) |
<рн2—<рн2
ОН ОН
втиленгликоль (этанднол)
Физические свойства. Этиленгликоль и глицерин — вязкие жидкости, сладкие на вкус, хорошо растворимые в воде.
Получение. 1. Гидролиз алкилгалогенидов:
|
4. + знВг. |
|
+ ЗВг2 |
|
П |
Н2 + 2NaOH – f <j3H2—^H2 + 2NaCl.
1 ОН ОН
|
Это качественная реакция на фенол. |
2. Двухатомные спирты получают окислением алкенов водным раствором перманганата калия: СН2=нСН2 + [О] + Н20 – f НОСН2—СН2ОН.
3. Глицерин получают гидролизом жиров.
Химические свойства, 1. Для двух – и трехатомных спиртов характерны основные реакции одноатомных спиртов,
2. Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется взаимным влиянием гидроксильных групп.
3. Качественная реакция на многоатомные спирты. При взаимодействии свежеосажденного гидроксида меди (II) с многоатомными спиртами, содержащими гидроксильные группы при соседних атомах углерода, образуется ярко-синий раствор.
Фенолы
Простейшие представители: ОН ОН
СН8
|
|
фенол о-крезол (2-метилфенол)
Строение. Неподеленная электронная пара атома кислорода втягивается в тг-электронную систему бензольного кольца (+М-эффект). Это приводит к а) увеличению электронной плотности в орто – и пара-положениях. бензольного кольца, б) ослаблению связи О—Н.
Физические свойства. Многие фенолы — кристаллические вещества. Они плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей.
Получение. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
СеН5—CI + 2NaOH – f С6Н5—ONa + NaCl + Н20.
Химические свойства. 1. Кислотные свойства фенола проявляются в реакциях с щелочными металлами и щелочами:
СеН5ОН + Na – f C6H5ONa + 1/2Н2|, С6Н5ОН + NaOH – f C6H5ONa + H20.
2. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах.
а) Галогенирование. При действии на фенол бромной воды образуется осадок.2,4,6-трибромфе – нола:
ОН ОН
Вгтф-Вг
Вг
б) Нитрование. Под действием концентрированной азотной кислоты образуется 2,4,6-тринитро – фенол.
в) Реакция поликонденсации с формальдегидом с образованием фенояформалъдегидных смол.
21. АЛЬДЕГИДЫ И КЕТОИЫ
|
Щ—ОН. |
Органические соединения, в молекуле которых имеется карбонильная группа >С=0, называются карбонильными соединениями. Они делятся на две группы — альдегиды и кетоны.
Альдегиды содержат в молекуле альдегидную группу —СН=0. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами. Общая формула предельных альдегидов и кетонов СлН2лО.
Простейшие представители: СН2=0 — формальдегид (муравьиный альдегид), СНз—СН==0 — ацетальдегид (уксусный альдегид, или этаналь), СН3—СО—СНз — ацетон (диметилкетон, или пропан он-2).
|
R—СН2—ОН. |
Изомерия. 1. Изомерия углеродного скелета. 2. Изомерия положения карбонильной группы (только для кетонов; начинается с С5Н10О), 3. Межклассовая изомерия между альдегидами и кетона – ми.
Строение. Атом углерода в карбонильной группе находится в состоянии вр2-гибридизации и образует 3 (Т-связи (две связи С—Н и одну связь С—О), тг-связь образована р-электронами атомов углерода и кислорода. Двойная связь С=0 является сочетанием <т – и тг-связей. Электронная плотность смещена в сторону атома кислорода:
Л+ S – >С— О.
Физические свойства. Карбонильные соединения не образуют водородных связей, поэтому их температуры кипения значительно ниже, чем соответствующих спиртов. Низшие альдегиды и кетоны — легкокипящне жидкости (формальдегид — газ) с резким запахом, хорошо растворимы в воде.
Получение. 1. Гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей Hg2+ и дает ацетальдегид СН3СНО в случае ацетилена и различные кетоны в случае гомологов ацетилена
|
+ СНз—СО—СН3. |
Hg2+,H+
СН3—С=нСН + н2о
2. Окисление спиртов. При окислении первичных спиртов образуются альдегиды, вторичных — кетоны:
СН3—СН2—ОН + СиО Л —► СН3—СН—Ю + Си + Н20,
СНз—СН(ОН)—СНз + СиО -4 —► СНз—СО—СНз + Си + Н20.
Химические свойства. 1. Реакции присоединения по двойной связи С=0. Активность альдегидов и кетонов в этих реакциях уменьшается в ряду: Н2С=0 > СН3—СН==0 > кетоны.
а) Присоединение циановодородной (синильной) кислоты:
СН3—СН=0 + Н—CN
сн3—<pi
CN,
Данная реакция используется для удлинения углеродной цепи и получения оксикислот.
б) Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами:
R—СН=0 + NaHS03 R—СН—S03Na.
ОН
в) Восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
Ni, I
R—СН=0 + Н2
Кетоны в этой реакции дают вторичные спирты.
2. Окисление, а) Реакция ♦ серебряного зеркала* — окисление альдегидов аммиачным раствором оксида серебра:
R—СН=0 + AgzO R—СО—ОН + 2Ag+.
б) Окисление альдегидов гидроксидом меди (II). В результате реакции выпадает осадок оксида меди (I) красного цвета:
СН3—СН=0 + 2Cu(OH)2 А —V СН3—СООН + Cu20± + 2Н20.
Данная реакция и реакция «серебряного зеркала» являются качественными реакциями на альдегиды.
22. КАРБОНОВЫЕ КИСЛОТЫ.
СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ
Карбоновые кислоты
Карбоновыми кислотами называются соединения, содержащие карбоксильную группу —СООН. По числу карбоксильных групп карбоновые кислоты делят на одноосновные (одна группа —СООН) и двухосновные (две группы —СООН).
Общая формула предельных одноосновных кислот с„н2„о2.
Простейшие представители: муравьиная кислота — НСООН, уксусная кислота — CH3COOH.
|
-г—I—г—г |
|
«Т—1—г-Т—1—г |
|
T~r |
|
i I |
Т~~Т— 1— г… 1— Г~’Г 1
Изомерия. 1. Для алифатических кислот — изомерия углеродного скелета. 2. Для ароматических кислот — изомерия положения заместителя в бензольном кольце. 3. Межклассовая изомерия со сложными эфирами.
Строение. Карбоксильная группа —СООН состоит из карбонильной группы > С=0 и гидрок – сильной группы —ОН, которые оказывают взаимное влияние друг на друга. Неподеленная электронная пара кислорода в гидроксиле смещена в сторону карбонильного углерода:
Это ослабляет связь О—Н и увеличивает кислотные свойства.
Физические свойства. Низшие одноосновные кислоты — бесцветные жидкости с резким запахом, с водой смешиваются в любых соотношениях. Высшие кислоты — твердые вещества, по мере увеличения углеводородного радикала растворимость в воде уменьшается. Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов.
Получение. 1. Окисление альдегидов и первичных спиртов. В качестве окислителей применяются КМп04 и К2СГ2О7.
R—СН2—ОН R—СО—Н R—СО—ОН
спирт альдегид кислота
2. Для получения бензойной кислоты можно использовать окисление гомологов бензола кислым раствором перманганата калия:
5С6Н5—СН3 + 6KMn04 + 9H2S04 —
— 5С6Н5СООН + 3K2S04 + 6MnS04 + 14Н20.
3. Муравьиную кислоту получают нагреванием оксида углерода (II) с гидроксидом натрия:
200°С Р h0so4
NaOH + СО ——- HCOONa 2 > НСООН.
4. Уксусную кислоту получают в промышленности каталитическим окислением бутана кислородом воздуха:
СНз—СН2—СН2—СНз 2СН3СООН.
Химические свойства. 1. Кислотные свойства. Все карбоновые кислоты окрашивают лакмус в красный цвет. Это обусловлено диссоциацией кислот:
R—СООН pt RCOO + Н+.
Карбоновые кислоты легко вступают в реакции с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH t Mg – (RCOO)2Mg + Н2, 2RCOOH + СаО – (RCOO)2Ca + Н20, RCOOH + NaOH – RCOONa + Н20,
RCOOH + NaHC03 – RCOONa + H20 + C02f.
Сильные минеральные кислоты вытесняют карбоновые кислоты из их солей:
CH3COONa + НС1 – СН3СООН + NaCl.
Образование функциональных производных. Путем замещения гидроксильной группы различными группами можно получать функциональные производные кислот общей формулы R—СО—X, где X — группа, замещающая группу —ОН:
R—СО—ОН + РС15 R—СО—CI + POCI3 + НС1,
хлорангидрид
r—со—он + н—о—со—r?2°5 t
-2HPOj,
—► R—СО—О—СО—R,
ангидрид
Все функциональные производные легко гидро – лизуются с образованием исходной кислоты: R—СО—X + Н20 -4 R—СО—ОН + НХ.
Галогенирование. При действии галогенов на кислоты в присутствии красного фосфора образуются а-галогензамещенные кислоты:
Р а Ркр
СНз—СН2—СООН + Вг2 —Ч
0
СН3—СНВг—СООН + HBr.
а-Галогензамещенные кислоты — более сильные кислоты, чем карбоновые, за счет -/-эффекта атома галогена.
Отдельные представители. Муравьиная кислота НСООН отличается рядом особенностей:
а) она разлагается под действием водоотнимаю – щих средств с образованием СО;
б) она является восстановителем и дает реакцию «серебряного зеркала»:
NHo
НСООН + AgaO—— U 2Agj. + С02 + Н20.
Одноосновные непредельные кнслоты — производные ненасыщенных углеводородов, у которых один атом водорода замещен карбоксильной группой.
Получение. Дегидрогалогенирование галогенза – мещенных кислот:
Кон, сп)
СН3—СН2—СНС1—СООН ■ д >
—► СНз—СН=СН—СООН.
Химические свойства. Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью — ос,(3- непредельные кислоты. За счет сопряжения двойных связей С=С и С=0 реакции присоединения к этим кислотам идут против правила Марковникова:
СН2=СН—СООН + HBr СН2Вг—СН2—СООН.
Сложные эфиры. Жиры
Сложные эфиры можно рассматривать как производные кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал.
R—СО—О—Н -f R—СО—О—R’.
Номенклатура. Сложные эфиры называют по кислотам и спиртам, которые участвуют в их образовании, например Н—СО—О—СНз — метилфор – миат, или метиловый эфир муравьиной кислоты; СН3—СО—О—С2Н5 — этилацетат, или этиловый эфир уксусной кислоты.
Физические свойства. Сложные эфиры низших кислот и спиртов — летучие жидкости, с приятным гапахом, малорастворимы в воде.
Получение. Взаимодействие спиртов и кислот (реакция этерификации):
н+
R—СО—ОН + Н—О—R’ R—СО—OR’ + Н20.
Химические свойства. 1. Гидролиз под действием воды — обратимая реакция. Для смещения равновесия вправо используют щелочи:
R—СО—OR’ + Н20 Я R—СО—ОН + R’OH,
R—СО—OR’ + NaOH – f R—СО—ONa + R’OH.
2. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
к—СО—OR’ + [Н] – f R—СН2—ОН + R’OH.
Жиры
Жиры представляют собой смеси сложных эфиров, образованных трехатомным спиртом глицерином и высшими жирными кислотами. Общая формула жиров:
|
СН—О—СО—R» Н2—О—СО—R’», |
—О—СО—R’
I
где R — радикалы высших жирных кислот.
|
н – но- н – н- |
|
-он – н |
|
снгон
^-циклическая форма |
|
сн, он
|
Основные предельные кислоты, образующие жиры, — пальмитиновая CisHeiCOOH и стеариновая С^НзбСООН; основные непредельные кислоты — олеиновая С^НззСООН и линоле – вая С17Н31СООН.
|
-с—он |
|
сн, он |
Физические свойства. Жиры, образованные предельными кислотами, — твердые вещества, а непредельными — жидкие. Все жиры очень плохо растворимы в воде.
|
альдегидная а-циклическая форма, форма |
Химические свойства. 1. Гидролиз, или омыление жиров, происходит под действием воды (обратимо) или щелочей (необратимо):
СН2—О—СО—R’
СН—О—СО—R» + 3NaOH – f
^Н2—О—СО—R’»
СН2—ОН + R’—COONa – f СН—ОН + R»—COONa
�н2—ОН + R’»—COONa.
При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами.
2. Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жиры из жидких превращаются в твердые.
23. УГЛЕВОДЫ
Углеводы — это органические соединения, имеющие общую формулу СтН2лО„ (/га, л > 3). Углеводы делят на три группы: моносахариды, олиго – сахариды и полисахариды.
Моносахаридами называются такие углеводы, которые не могут гидролизоваться с образованием более простых углеводов, например: глюкоза, фруктоза. Олигосахариды — это продукты конденсации двух или нескольких моносахаридов, например сахароза. Полисахариды (крахмал, целлюлоза) образованы большим количеством молекул моносахаридов.
Моносахариды
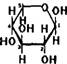
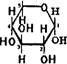
Глюкоза CqH^Oq — белые кристаллы, сладкие на вкус, хорошо растворимые в воде.
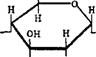
Строение. Молекулы глюкозы могут существовать в линейной и циклических формах. В линейной форме глюкоза представляет собой альдегидо – спирт с пятью гидроксильными группами. Циклические формы (а – и /3-глюкоза) могут образовываться из линейной при взаимодействии гидроксиль – ной группы при 5-м атоме углерода с карбонильной группой:
«
-Гон
Это равновесие существует в водном растворе.
Химические свойства. 1. Реакции альдегидной группы, а) Глюкоза окисляется аммиачным раствором оксида серебра и гидроксидом меди (II) в глюконовую кислоту при нагревании:
СН2ОН—(СНОН)4—СН=0 + Ag20 —
— СН2ОН—(СНОН)4—СООН + 2Ag4-> СН2ОН—(СНОН)4—СН=0 + 2Си(ОН)2 —
— СН2ОН—(СНОН)4—СООН + Cu20 + 2Н20.
б) Глюкоза может восстанавливаться в шестиатомный спирт сорбит:
СН2ОН—(СНОН)4—СН=0 + 2[Н] – f – f СН2ОН—(СНОН)4—СН2ОН.
в) Глюкоза не вступает в некоторые реакции, характерные для альдегидов, например в реакцию с NaHS03.
2. Реакции гидроксильных групп.
а) Глюкоза дает синее окрашивание с гидроксидом меди (II) (качественная реакция на многоатомные спирты).
б) Образование простых эфиров. При действии метилового спирта один из атомов водорода замещается на группу —СН3. В эту реакцию вступает гликозидный гидроксил, находящийся при 1-м атоме углерода в циклической форме глюкозы.
СН2ОН
н/ГЛн
ОН н
+ iH’j-O—СНа – Д-+
НО
н 6н
СН2ОН
|
н |
|
н ОН |
н
+ н2о.
н
|
НО |
|
н |
О—СНз
|
\ Н ОН / л |
он
|
о- |
в) Образование сложных эфиров. Под действием уксусного ангидрида все пять групп —ОН в молекуле глюкозы замещаются на группу
|
Химические свойства. 1. Гидролиз при нагревании в кислой среде. Конечным продуктом гидролиза является глюкоза: |
—О—СО—СН3.
|
нт, ( |
3. Брожение — зто процесс расщепления глюкозы под действием различных микроорганизмов, а) спиртовое брожение:
|
(СбН10О5)„ +и н2о |
|
♦ пС6Н12Ов. |
С6Н1206 – 2С2Н5ОН + 2C02f.
б) молочнокислое брожение:
С6Н12Ов – 2СН3—СН(ОН)—СООН.
молочная кислота
Фруктоза — это изомер глюкозы. Как и глюкоза, она может существовать в линейной и циклических формах. В линейной форме она представляет собой кетоноспирт с пятью гидроксильными группами:
б 5 4 3 2 1 СН2-—^^—^^—^^—If— ОН ОН ОН ОН О ОН
Фруктоза вступает во все реакции многоатомных спиртов, но, в отличие от глюкозы, не реагирует с аммиачным раствором оксида серебра.
Сахароза
Сахароза Ci2H22On — белое кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде. Молекула сахарозы состоит из двух циклов: 6-членного (остатка глюкозы) и 5-членного (остатка фруктозы), соединенных за счет гликозидного гидроксила глюкозы.
Химические свойства. 1. Гидролиз: н+ ,
С,2Н22Ои + Н20—— ‘—у СвН12Оа + СвН12Ов.
сахароза глюкоза фруктоза
2. Сахароза реагирует с гидроксидом кальция с образованием сахарата кальция.
3. Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосста – навливающим дисахаридом.
Полисахариды
Крахмал представляет собой белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор в горячей воде.